本篇目录:
企业设备gmp怎么认证
1、GMP认证的流程:企业到省局受理大厅提交认证申请和申报材料 。药品安全监管处对申报材料形式审查 (5个工作日) 。中心对申报材料进行技术审查 (10个工作日) 。
2、申请:申请人向省政务大厅食品药品监督管理局窗口提交《药品GMP认证申请书》(一式两份)及申请书电子文档,并附相关材料。
3、药品GMP认证流程 申报企业到省局受理大厅提交认证申请和申报材料。省局药品安全监管处对申报材料形式审查(5个工作日)。认证中心对申报材料进行技术审查(10 个工作日)。认证中心制定现场检查方案(10个工作日)。
GMP中设备再验证需要做什么
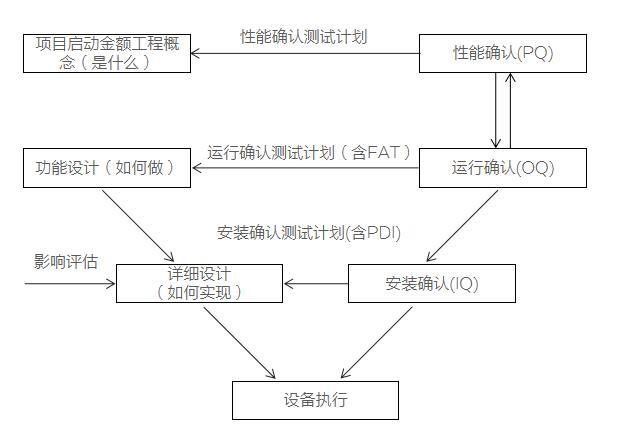
1、gmp设备验证的四个阶段介绍如下:设计确认(DQ)、安装确认(IQ)、运行确认(OQ)、性能确认(PQ)。
2、设备的校准和设备验证不是同一回事,设备必须经过空载、加载、满载运行试验验证。比如说杀菌器一般是校准里面的温度、压力、时间等,但试剂的灭菌效果怎么样,校准里就没提到,这就需要做设备的性能验证试验。
3、所谓再验证,系指一项生产工艺、一个系统或者一种原材料经过验证并在使用一个阶段以后,旨在证实其“验证状”没有发生漂移而进行的验证。可分为强制性再验证和检定、改变性再验证、定期再验证三种类型。
4、设备未进行大修,或未变更主要部件,要保留原来的验证文件,再验证时不必进行DQ、IQ直接从OQ、PQ做起!如设备进行过大修,或主要部件进行了更新或改进,则需进行DQ、IQ。希望对你有用。
跪求:制药设备再验证的定义!!
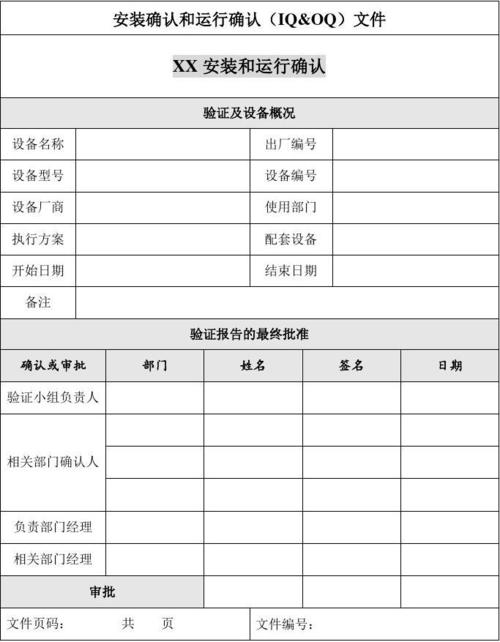
iqoqpq验证是设备验证意思。3Q认证是通过设备验证进行质量保证的一部分,是确定正在使用或安装的设备提供高质量保证的一个方法,对于实验室、制药等行业专用设备一般都需要进行3Q认证。

顾名思义就是对仪器的安装过程进行确认(或验证)。
验证,顾名思义就是检验证明。其主要目的就是为了证明药品的生产过程、设备、物料、活动或系统确实能达到预期结果;可以保证我们的生产过程能够始终符合预定的标准要求。
药品生产验证的定义,验证就是任何程序、生产过裤庆程、设备、物料、活动或系统确实能达到预期结果的有文件证明的一系列活动。验证即检验证明,核实某事物或行为的雀亏真实性,例如网络上的验证码等。
☆ 现阶段设备验证内容:(一)对设备在选型、设计、制造、安装、运行及性能等各个环节进行检查和评估,以证实设备是否符合药品生产的要求,是否满足设备安全有效的功能保证。
湿热灭菌工艺验证包括哪些内容
1、湿热灭菌法包括蒸汽灭菌、温热气体灭菌、煮沸。蒸汽灭菌:也称为压力蒸汽灭菌或自动消毒。将物品放入密封的蒸汽灭菌器中,通过加热使水蒸气产生,持续加热一定时间以杀灭细菌和病毒。
2、工艺验证应当包括首次验证、影响产品质量的重大变更后的验证、必要的再验证以及在产品生命周期中的持续工艺确认,以确保工艺始终处于验证状态。
3、湿热灭菌工艺监测的参数应当包括灭菌时间、温度或压力。
4、工艺验证包括生产工艺验证和产品工艺验证。A) 生产工艺验证:主要指具体的单元操作工艺(例如:层析上样量验证、培养基无菌灌装验证、过滤效果的验证、清洁灭菌效果的验证、包装容器的密封性等)。
确认或验证的范围和程度应当经过什么来确定
对于工厂、设施和设备,确认状态通过例行监测、维护和校准程序、计划和实施来保持;通过对日常数据和设施设备确认数据的定期评估,确定是否需要再确认或再确认的程度。
是中国GMP第七章《确认与验证》第一百三十八条:企业应当确定需要进行的确认或验证工作,以证明有关操作的关键要素能够得到有效控制。确认或验证的范围和程度应当经过风险评估来确定。
)新版GMP要求确认和验证的范围和程度要经过风险评估来确定。
确认或验证的范围和程度应当经过风险评估来确定。 15企业的厂房、设施、设备和 检验仪器应当经过确认,应当采 用经过验证的生产工艺、操作规程和检验方法进行生产、操作和检验,并保持持续的验证状态。
比较这两个定义,便可看出离开了“特定的预期用途或应用要求”,就不存在确认问题。对生产通用设备的组织,没有确定的顾客(业主),因此,只进行“验证”即可,但应明确其使用范围和环境的要求。
到此,以上就是小编对于设备再验证周期的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏